พันธะเคมี
พันธะเคมีของอะตอม คือ แรงยึดเหนี่ยวระหว่างอะตอม ซึ่งเป็นสิ่งที่สำคัญพอ ๆ กับตัวอะตอมเอง เพราะหากมันไม่เกิดการจับตัวกันระหว่างอะตอม ก็อาจจะไม่มีโมเลกุล สสาร สารประกอบ เนื้อเยื่อ อวัยวะ ร่างกาย หรือหน่วยของสิ่งมีชีวิตและไม่มีชีวิตต่าง ๆ ที่อยู่บนโลกนี้เกิดขึ้นได้เลย มันคงจะเป็นแค่อะตอมซึ่งล่องลอยอย่างอิสระไปทั่ว เมื่ออะตอมจับตัวอยู่ด้วยกันจะได้เป็นโมเลกุล โดยแต่ละโมเลกุลก็จะจับตัวกันมากขึ้น เป็นโครงสร้างที่ซับซ้อนมากขึ้น
พันธะเคมีของอะตอม (Atomic Bonds) ประกอบไปด้วย พันธะไอออนิก พันธะโคเวเลนต์ พันธะโลหะ โดยไม่รวมถึงพันธะระหว่างโมเลกุลซึ่งมีความแตกต่างกันออกไปอีก
กฎออกเตด ( Octet rule )
จากการศึกษาเกี่ยวกับธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น
2He = 2 10Ne = 2 , 8 18Ar = 2 , 8 , 8 36Kr = 2 , 8 , 18 , 8
ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น
1H = 1 6C = 2 , 4 7N = 2 , 5 8O = 2 , 6
ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า
การที่อะตอมของธาตุต่างๆ รวมตัวกันด้วยสัดส่วนที่ทำให้วาเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎขึ้นเรียกว่า กฎออกเตต
การรวมกันเพื่อทำให้อะตอม มีวาเลนต์อิเล็กตรอนครบ 8 อาจมีลักษณะดังนี้
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันเป็นคู่ๆ จะเกิด "พันธะโคเวเลนต์ "
- อะตอม ให้หรือรับอิเล็กตรอน จะเกิดเป็น " พันธะไอออนิค "
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันทั้งก้อน จะเกิดเป็น " พันธะโลหะ "
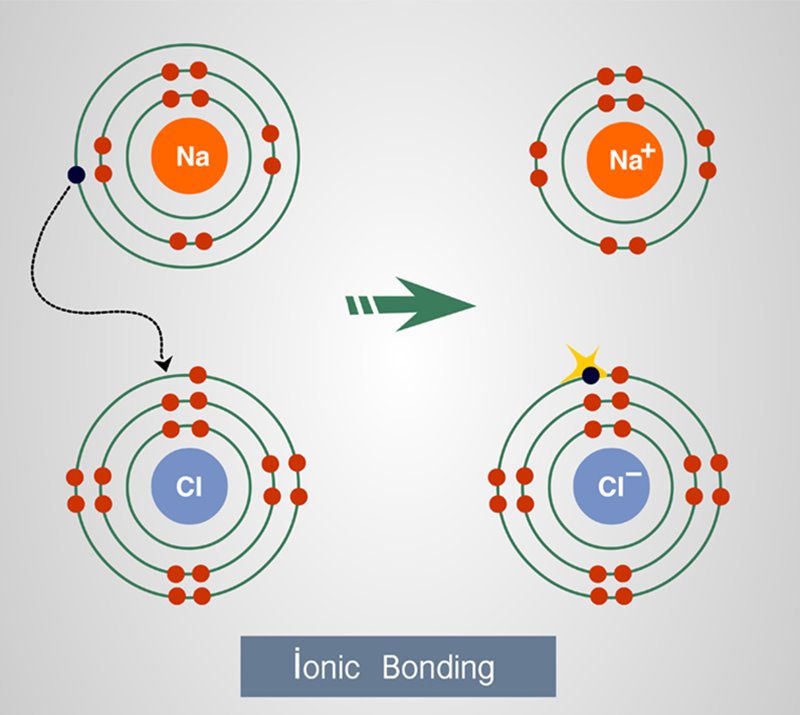
พันธะไอออนิก (Ionic Bond)
เป็นพันธะที่เกิดขึ้นระหว่างอะตอมซึ่งมีประจุตรงข้ามกัน และดึงดูดเข้าหากันจากการเคลื่อนย้ายอิเล็กตรอนหนึ่งตัวหรือมากกว่า จำนวนอิเล็กตรอนซึ่งอยู่วงนอกสุดของอะตอมหนึ่งไปอยู่ร่วมกับกลุ่มอิเล็กตรอนวงนอกสุดของอีกหนึ่งอะตอม เพื่อให้จำนวนอิเล็กตรอนวงนอกสุดของทั้งสองอะตอมครบออกเตต (Octet)
การจับคู่พันธะแบบไอออนิกนี้เกิดขึ้นระหว่างอะตอมของโลหะกับอะตอมของอโลหะ โดยอะตอมโลหะให้อิเล็กตรอนแก่อะตอมของอโลหะ ยกตัวอย่างเช่น อะตอมโซเดียม (Na) และอะตอมคลอรีน (Cl) กลายเป็นโซเดียมคลอไรด์ (NaCl) หรือเกลือ โซเดียมมีอิเล็กตรอนวงนอกสุด 1 ตัว จึงยกอิเล็กตรอนตัวนี้ให้แก่อะตอมคลอรีน ทำให้อะตอมโซเดียมเองมีประจุเป็นบวก เนื่องจากมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 1 ตัว ในฝั่งของอะตอมคลอรีนมีอิเล็กตรอนวงนอกสุด 7 ตัว เมื่อได้รับอิเล็กตรอนเข้ามาเพิ่มอีก 1 ตัวทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตอนในอะตอมของตัวเองอยู่ 1 และทำให้มันมีประจุเป็นลบ
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเป็นพันธะที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไนเซชันสูง
3. พันธะไอออนิก อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ
4. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สตรเอมพิริคัล ( สูตรอย่างง่าย )
5.สารประกอบไอออนิกมีจุดดือดและจุดหลอมเหลวสูง
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้ เกิดเป็นสารอิเล็กโทรไลดต์จึงนำไฟฟ้าได้
โครงสร้างของสารประกอบไอออนิก
โครงสร้างของสารประกอบไอออนิกมีลักษณะเป็นโครงผลึกร่างตาข่าย ประกอบด้วยไอออนบวกและไอออนลบสลับกัน ไม่สามารถแบ่งแยกเป็นโมเลกุลเดี่ยวๆได้ ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่างๆใน 1 โมเลกุลได้ แต่สามารถหาอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น จึงไม่สามารถเขียนสูตรโมเลกุลของสารประกอบไอออนิกได้ ใช้สูตรเอมพิริคัลแทนสูตรเคมีของสารประกอบไอออนิก
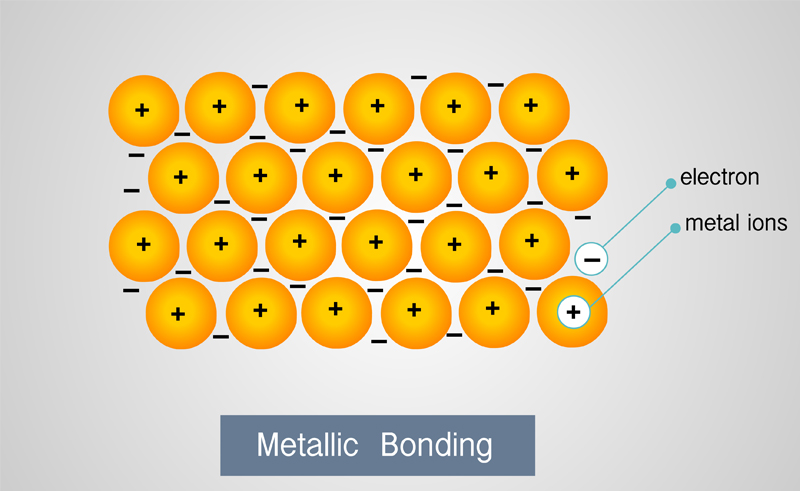
พันธะโลหะ (Metallic Bond)
เป็นพันธะซึ่งเกิดขึ้นกับอะตอมของธาตุที่เป็นโลหะ เกิดขึ้นเมื่ออะตอมของโลหะแบ่งกันใช้อิเล็กตรอนวงนอกสุดของอะตอม โดยที่อิเล็กตรอนที่แบ่งกันใช้นี้ไม่ได้เป็นส่วนหนึ่งของอะตอมใดอะตอมหนึ่งโดยสมบูรณ์ และนั่นทำให้มีการเคลื่อนที่ของอิเล็กตรอนอยู่ตลอดเวลา ทุก ๆ อะตอมของโลหะจึงอยู่ใกล้กับอะตอมอื่นยาวไปอย่างไม่สิ้นสุด และนั่นทำให้ธาตุโลหะไม่มีสูตรโมเลกุล
ยกตัวอย่างเช่น อะตอมของเหล็ก (Fe) อยู่รวมกันเป็นจำนวนมากจนกลายเป็นแผ่นเหล็กหรือแท่งเหล็กได้ โดยไม่มีการกำหนดตัวเลขจำนวนอะตอมในหนึ่งโมเลกุล และการเคลื่อนที่ได้อย่างอิสระของอิเล็กตรอนนี้เองที่ทำให้โลหะสามารถนำประจุไฟฟ้าได้ดี เพราะอิเล็กตรอนที่ถูกเติมเข้ามาในโลหะสามารถไหลจากจุดหนึ่งไปยังจุดใด ๆ ได้อย่างอิสระ ดังนั้น หากมีแท่งเหล็กและมีการต่อไฟฟ้าเข้าที่จุดใดจุดหนึ่งของแท่งเหล็ก เมื่อคุณจับหรือสัมผัสส่วนใดของแท่งเหล็กก็จะช็อตได้ทั้งสิ้น เช่นเดียวกับการถ่ายโอนความร้อนด้วยการนำความร้อนให้กระจายไปทั่ว การเคลื่อนที่ของอิเล็กตรอนที่เป็นอิสระนี้เองก็ทำให้โลหะมีลักษณะมันวาว เนื่องจากความสามารถในการสะท้อนแสงได้ดี นอกจากนั้นการที่แต่ละอะตอมใช้อิเล็กตรอนวงนอกสุดร่วมกัน ทำให้อะตอมอยู่ใกล้ชิดกันอย่างเหนียวแน่นและนั่นทำให้ธาตุโลหะส่วนใหญ่มีจุดหลอมเหลวสูงอีกด้วย
การที่โลหะมีพันธะโลหะจึงทำให้โลหะมีสมบัติทั่วไป ดังนี้
1. โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
2. โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
3. โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
4. โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
5. สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
6. โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง
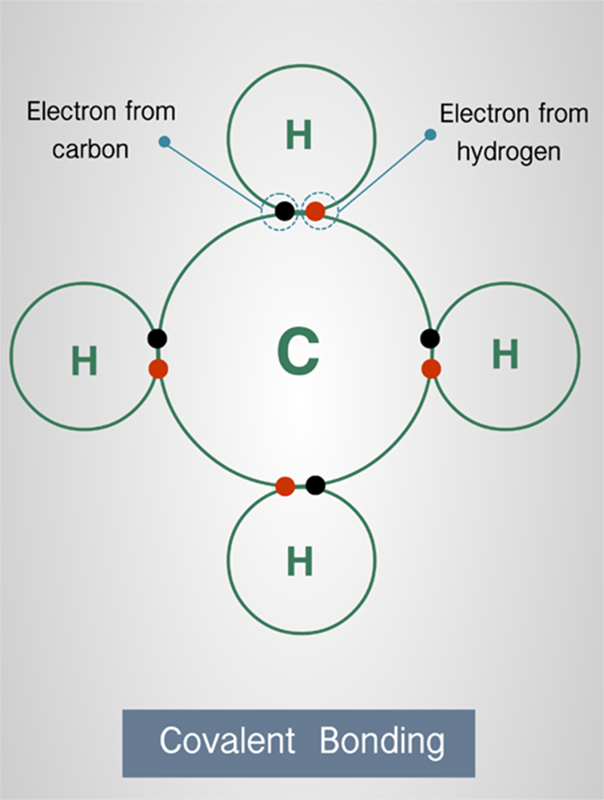
พันธะโคเวเลนต์ (Covalent Bond)
เป็นการใช้อิเล็กตรอนร่วมกันของอะตอมคู่หนึ่ง ซึ่งอะตอมคู่นี้เป็นอะตอมของธาตุอโลหะ คุณสมบัติของอะตอมธาตุอโลหะคือ มีค่าพลังงานไอออไนเซชั่น (Ionization) สูง กล่าวคือ ความสามารถในการยึดเหนี่ยวอิเล็กตรอนเอาไว้ ไม่ยอมปล่อยให้อะตอมอื่นเอาไปใช้ได้ จึงทำให้อะตอมที่มาจับเข้าคู่กันจำเป็นต้องแบ่งปันอิเล็กตรอนกันโดยไม่มีอะตอมไหนสูญเสียอิเล็กตรอนออกไป โดยหลักแล้วคือ การแบ่งปันโดยยอมให้อะตอมอื่นใช้อิเล็กตรอนได้จำนวนเท่า ๆ กันกับที่ดึงดูดอิเล็กตรอนจากอะตอมอื่น นั่นก็เพื่อให้อิเล็กตรอนวงนอกสุดของอะตอมครบจำนวนตามกฎออกเตต
พันธะโคเวเลนต์ยังสามารถแบ่งย่อยออกไปได้อีก 3 แบบ ตามจำนวนคู่ของอะตอมที่แบ่งปันกัน ได้แก่ 1 คู่ 2 คู่ และ 3 คู่ และนั่นทำให้ธาตุอโลหะไม่สามารถอยู่เป็นอะตอมเดี่ยว ๆ ได้ แต่จำเป็นต้องจับตัวคู่กันเป็นอย่างน้อยเพื่อให้เป็นโมเลกุลที่เสถียร โดยยิ่งแบ่งคู่อิเล็กตรอนระหว่างกันมากเท่าไร ก็จะยิ่งมีความยาวพันธะน้อยลง แต่มีพลังงานของพันธะมากขึ้น
ลักษณะสำคัญของพันธะโคเวเลนต์
- พันธะโคเวเลนต์ เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนร่วมกันของอะตอมที่มีค่าพลังงานไอออไนเซชันสูง กับอะตอมที่มีค่าพลังงานไอออไนเซชันสูงด้วยกัน
- ธาตุที่เกิดพันธะโคเวเลนต์ได้เป็นอโลหะ เพราะอโลหะมีพลังงานไอออไนเซชัน (IE) ค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก จึงไม่มีฝ่ายใดเสียอิเล็กตรอน แต่จะใช้อิเล็กตรอนร่วมกัน
การเกิดพันธะโคเวเลนต์
การเกิดพันธะโคเวเลนต์ เกิดจากอะตอมส่งอิเล็กตรอนออกมาฝ่ายละเท่าๆกัน ใช้อิเล็กตรอนร่วมกัน ให้อะตอมมีเวเลนต์อิเล็กตรอนครบ 8 (เป็นไปตามกฎออกเตต)
การเขียนสูตรและการเรียกชื่อสารโคเวเลนต์
- สูตรโมเลกุล โดยทั่วไปเขียนสัญลักษณ์ของธาตุที่เป็นองค์ประกอบเรียงตามลำดับของธาตุ และค่าอิเล็กโทรเนกาติวิตี ( เรียงลำดับก่อนหลังดังนี้ B , Si , C , P , H , S , I , Br , Cl , O และ F ) แล้วระบุจำนวนอะตอมของธาตุที่เป็นองค์ประกอบของโมเลกุล เช่น CO2 , HCl . NH3 , PCl3 , NO3 ฯลฯ
- สูตรโครงสร้าง คือสูตรที่แสดงให้ทราบว่า 1 โมเลกุลของสารประกอบด้วยธาตุใดบ้าง อย่างละกี่อะตอม และอะตอมของธาตุเหล่านั้นมีการจัดเรียงตัวหรือเกาะเกี่ยวกันด้วยพันธะอย่างไร ซึ่งแบบเป็น 2 แบบคือ
- สูตรโครงสร้างแบบจุด คือสูตรโครงสร้างที่แสดงถึงการจัดอิเล็กตรอนวงนอกสุดให้ครบออกเตต ในสารประกอบนั้น โดยใช้จุด ( . ) แทนอิเล็กตรอน 1 ตัว
- สูตรโครงสร้างแบบเส้น คือสูตรโครงสร้างที่แสดงถึงพันธะเคมีในสารประกอบนั้นว่าพันธะใดบ้าง โดยใช้เส้น ( - ) แทนพันธะเคมี เส้น 1 เส้น แทนอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่
การอ่านชื่อสารโคเวเลนต์ มีวิธีการอ่านดังนี้
- อ่านจำนวนอะตอมพร้อมชื่อธาตุแรก (ในกรณีธาตุแรกมีอะตอมเดียวไม่ต้องอ่านจำนวน )
- อ่านจำนวนอะตอม และชื่อธาตุที่สอง ลงท้ายเป็น ไ-ด์ (ide )
เลขจำนวนอะตอมอ่านเป็นภาษากรีก คือ ตัวอย่าง
1 = mono 2 = di 3 = tri 4 = tetra
5 = penta 6 = hexa 7 = hepta 8 = octa
9 = nona 10 = deca 11 = undec 12 = dodec
NO2 อ่านว่า ไนโตรเจนไดออกไซด์ Cl2O อ่านว่า ไดคลอรีนโมโนออกไซด์
P4O10 อ่านว่า เตตระฟอสฟอรัสเดคะออกไซด์ CCl4 อ่านว่า คาร์บอนเตตระคลอไรด์
พลังงานพันธะและความยาวพันธะ
พลังงานพันธะ หมายถึง พลังงานที่ใช้เพื่อสลายพันธะที่ยึดเหนี่ยวระหว่างอะตอมคู่หนึ่งๆในโมเลกุลในสถานะก๊าซ
พลังงานพันธะเฉลี่ย หมายถึง ค่าพลังงานเฉลี่ยของพลังงานสลายพันธะ ของอะตอมคู่หนึ่งๆซึ่งเฉลี่ยจากสารหลายชนิด
ความยาวพันธะ หมายถึง ระยะระหว่างนิวเคลียสของอะตอมคู่หนึ่งๆที่สร้างพันธะกันในโมเลกุล ความยาวพันธะระหว่างคู่เดียวกันมีค่าต่างกันได้ เมื่ออยู่ในสารประกอบต่างชนิดกัน และความยาวพันธะเป็นคิดเป็นค่าเฉลี่ย เรียกว่า ความยาวพันธะเฉลี่ย

ไม่มีความคิดเห็น:
แสดงความคิดเห็น